سلام دوستان این وبلاگ تا مدتی به روز نمیشه اما اگه از مطالب ما خوشتون اومده یا سوالی در مورد شیمی و کاربردش داشتید به کانال تلگرامی ما یه سر بزنید تا اونجا به تمامی سوال هاتون پاسخ داده بشه.
اینم آدرس کانال ما:https://telegram.me/shimiology
سلام دوستان این وبلاگ تا مدتی به روز نمیشه اما اگه از مطالب ما خوشتون اومده یا سوالی در مورد شیمی و کاربردش داشتید به کانال تلگرامی ما یه سر بزنید تا اونجا به تمامی سوال هاتون پاسخ داده بشه.
اینم آدرس کانال ما:https://telegram.me/shimiology

کافئین (C8H10N4O2) نام عمومی تری متیل زانتین (trimethylxanthine) است، که به طور علمی و دقیق تر 7،3،1 – تری متیل زانتین (1,3,7trimethylxanthine) نامیده می شود.
کافئین در طبیعت از روش های مختلفی بدست می آید. از جمله ی این روش ها می توان به تهیه ی کافئین از دانه های قهوه، لوبیای کاکائو، دانه های گئورانا (guarana) یا برگ چایی اشاره نمود.گیاهان از کافئین به عنوان آفت کش استفاده می کنند. این ماده تلخ باعث دور شدن حشرات از گیاه می شود. این ماده باعث مرگ یا فلج شدن حشراتی می شود که می خواهند از گیاه تغذیه نموده یا به آن حمله نمایند. این مولکول برای اولین بار در سال 1819 توسط یک شیمیدان آلمانی به نام فردیناند فردریش رانگ (Friedrich Ferdinand Runge) جداسازی شد. کافئین خالص پودری سفید رنگ و به شدت تلخ است. این ماده به کولا و یا نوشابه های بدون الکل افزوده می شود تا تلخی و سرخوشی دوست داشتنی ای را ایجاد نماید. اما باید توجه داشت که کافئین یک افزودنی اعتیاد آور است.
کافئین مرکز سیستم عصبی را تحریک کرده، باعث افزایش ضربان قلب شده و سیستم تنفسی را تحت تاثیر قرار می دهد. همچنین کافئین یک روانگردان ملایم بوده و تا حدی نیز مدر است.
دز طبیعی کافئین حدود 100 میلی گرم است که تقریبا با میزان کافئین موجود در یک فنجان قهوه برابر است. با این حال بیش از نیمی از بزرگسالان در امریکا روزانه بیش از 300 میلی گرم کافئین مصرف می کنند که این امر باعث شده تا کافئین به پر طرفدارترین داروی اعتیاد آور در امریکا تبدیل شود.کافئین روزانه با مصرف قهوه، شکلات، چایی و نوشابه های سیاه وارد بدن ما می شود و مصرف بیش از حد آن ایجاد حالت ضد محرکی می نماید. پزشکان معتقدند کافئین با مسدود کردن گیرنده های آدنوزین(adenosine) در مغز و سایر اندام باعث مسمومیت می شود. کاهش اتصال آدنوزین(adenosine) به گیرنده ها باعث کاهش فعالیت های سلولی می گردد. تحریک سلول های عصبی باعث رها سازی هورمون اپی نفرین (آدرنالین) ((epinephrine (adrenaline) شده که موجب افزایش ضربان قلب، فشار خون و جریان خون به ماهیچه ها می شود که به تبع آن جریان خون به پوست و سایر اندام کاهش می یابد. همچنین با آزادسازی آدرنالین کبد شروع به تولید و آزادسازی گلوکز می نماید. کافئین هم چنین سطوح انتقال دهنده ی عصبی دوپامین(dopamine) را افزایش می دهد.
کافئین به سرعت از مغز زدوده شده و خارج می گردد. چون تاثیر آن کوتاه مدت است بر عملکرد مغز تاثیر منفی گذاشته ومغز غلظت بیشتری از کافئین را طلب می کند. هرچند مصرف مستمر کافئین باعث افزایش ظرفیت مغز در مقابل آن می شود، اما این شرایط تحمل باعث کاهش میزان آدنوزین ترشح شده می گردد که خود منجر به کاهش فشار خون می گردد. در شرایط حاد کاهش فشار خون با سردرد، سرگیجه و بقیه علائم همراه است.
مقدار زیاد کافئین می تواند مسمومیت با کافئین را ایجاد کند که در این صورت با عصبانیت، هیجان، استرس، افزایش دفع ادرار، سرخی صورت، دست ها و پاهای سرد، اختلالت روده ای و همچنین توهم مواجه می شویم. در برخی افراد این علائم حتی با مصرف دز بسیار پایینی از کافئین به وقوع می پیوندد. مثلا در مواردی مشاهده شده شخص با مصرف 250 میلی گرم کافئین در روز دچار علائم فوق گردیده است. دز کشنده ی کافئین برای یک شخص بزرگسال مابین 13 تا 19 میلی گرم تخمین زده می شود. در حالیکه حتی مقدار بسیار کمی از این ماده می تواند برای حیوانات خانگی ای مانند طوطی، سگ یا اسب بسیار خطرناک و کشنده باشد. مصرف کافئین برای جلوگیری از ابتلا به دیابت نوع B می تواند مفید باشد. علاوه بر استفاده ی از کافئین به عنوان یک محرک و طعم دهنده، کافئین در بیشتر داروهای ضد سردرد نیز استفاده می شود.
منبع:www.asemooni.com

سیستم عیار ابتدا در بریتانیا در سال 1300 میلادی به منظور آسان کردن تجارت طلا ابداع شد.
در ایالات متحده پائین ترین عیار مجاز برای طلا 10 است اما یک خطای 2/1 عیار نیز مجاز است به طوری که طلائی بعنوان 10 عیار فروخته می شود که ممکن است فقط شامل 5/9 عیار یا 6/36 در صد وزنی طلا باشد.
در بریتانیا اقلام دیگری که فقط شامل 9 عیار هستند نیز فروخته می شوند اما به هیچ عنوان کمتر بودن از این مقدار مجاز نیست حداقل عیار در فرانسه نیز 18 است. بقیه آلیاژ می تواند انواعی از فلزات دیگر نظیر مس، نیکل یا نقره باشد. ترکیب آلیاژ در بازار فاش نمی شود و آلیاژهای فلزی مختلف باعث رنگهای مختلف می شوند مثلاً در ساعتهای جیبی که در قرن نوزدهم در انگلیس ساخته می شد، سه رنگ مختلف از طلا دیده می شود.
فلزات استفاده شده برای ایجاد رنگهای مختلف عبارتند از :
زرد: ((طلا، مس، نقره، روی)) سفید: ((طلا، مس، نیکل، روی)) قرمز : ((طلا، مس)) سبز: ((طلا، نقره)) آلیاژی که طلای سبز نامیده می شود (البته فقط اندکی سبز است) و به ندرت نیز در بازار یافت می شود.
اصطلاح عمومی «آزمون اسید» عبارتست از آزمایش کردن آلیاژهای طلا با نیتریک اسید. آلیاژی با مقدار طلای 9 یا 10 عیار به سرعت سبز می شود. ترکیباتی با بیش از 18 عیار به وسیله مخلوطی با حجم تقریباً برابر از هیدروکلریک اسید و نیتریک اسید که تیزاب سلطانی نامیده می شود، آزمایش می شوند. یک نقطه کوچک از آلیاژ تحت تأثیر این مخلوط سریعاً رنگ زرد کمرنگ به خود می گیرد. اما معمولاً برای جلوگیری از ضرر ناشی از تلف شدن جواهر این آزمون با استفاده از یک سنگ محک (سنگ معیار) انجام می گیرد، سنگ معیار سنگی است سخت، سیاه و تا حدی سائیده که شیئی مورد نظر با شدت روی آن مالیده می شود که با این ترتیب یک مقدار کم از فلز توسط سطح سنگ برداشته می شود. آزمون روی سطح سنگ انجام می گیرد و پس از آن جواهر مالیده شده مجددا می تواند برداشته شود.
جالب است بدانیم بسیاری از اصطلاحات بکار برده شده در این آزمون ها، ناشی از بررسی هایی هستند که در زمان معاصر انجام گرفته اند اصطلاحاتی نظیر سنجش عیار، آزمون اسید و سنگ محک. بنا به نظر شیمیدانان مقدار عیار فقط حداقل درصد وزنی طلا را مشخص می کند و اشاره ای به غلظت اجزای دیگر آلیاژ نمی کند به این معنی که یک قطعه طلای 18 عیار دارای 0 تا 25 درصد وزنی یا 0 تا 51 درصد مولی مس است مخلوطهائی که شامل نیکل و روی هستند نیز به دلیل اینکه میانگین جرم های اتمی آنها تقریباً برابر با جرم اتمی مس است همان نسبتهای مولی را دارند. این پرسش را که آیا امکان اکسید کردن فلز در چنین آلیاژهائی و تولید احتمالی یک نمک فلزی رنگی وجود دارد یا خیر می توان با توجه به پتانسیلهای استاندارد پاسخ گفت و این اعداد برای عناصری که اجزای اصلی آلیاژهای طلا را تشکیل می دهند عباتند از :
Ag++e → Ag E = 0 .80 V , Au3++3 e → Au E = 1.42 V
Zn2++ 2e → Zn E = – 0.76 V , Ni2++2e → Ni E = – 0.23 V
, Cu2++2e → Cu E = 0.34
این داده ها مشخص می کنند که چرا طلا فلز بی اثر است. پتانسیل مورد نیاز برای اکسید کردن آن نزدیک به حداکثر پتانسیلی است که در محلولهای آبی قابل حصول است. مثلاً اتصال نیم پیلهای:
Cu (S) → Cu2++2e E = – 0.34 V و یا Au(S) → Au3++3e E = – 1.42V
با نیم پیل یک اکسید کننده خوب نظیر:
NO3 +4 H3O++3e → NO + 6H2O E = 0.96 V
آشکار میکند که نیتریک اسید نمی تواند طلا را اکسید کند اما مس را به آسانی اکسید می کند. اما به هر حال پیش بینی شرایطی که یک فلز ممکن است در آن شرایط اکسید شود، بیشتر به پتانسیل مورد نیاز برای تولید یون فلزی خالص یا آب پوشیده بستگی دارد. همچنین باید در نظر داشت که یون فلزی برای پایداری در محلول ممکن است تشکیل کمپلکس دهد. تشکیل چنین کمپلکسی است که مشخص می کند چرا نیتریک اسید اکسید کننده و هیدروکلریک اسید کمپلکس دهنده برای حل کردن طلا مورد نیاز هستند. این مخلوط تیزاب سلطانی نامیده میشود گفتنی است تیزاب سلطانی اصطلاحی است که کیمیاگران قدیمی در مورد محلولهای حل کننده فلزات بی اثر بکار می بردند. معادله انحلال طلا در تیزاب سلطانی را می توان به صورت زیر نشان داد:
Au + 4 Cl + NO3 + 4H3O+ → AuCl 4 + NO + 6H2 O
با توجه با پتانسیل واکنشی:
AuCl 4 + 3e → Au + 4Cl E = 1.00 V
انحلال طلا از نظر ترمودینامیکی در تیزاب سلطانی مطلوب است. سطح مس، نیکل و نقره تحت تاثیر هوای معمولی یا هوای حاوی یونهای سولفید نقره می شود. اما طلای خالص، حتی زمانی که تحت تاثیر نیتریک اسید غلیظ با هیدروکلریک اسید غلیظ قرار بگیرد بدون تغییر باقی می ماند. یون کلرید موجود در عرق بدن نیز می تواند اکسایش فلزات همراه در جواهرات آلیاژی را تسریع کند. اما علت اینکه این فلزات چه در کارهای دندانپزشکی و چه به همراه طلا در گوشواره ها و گردنبندها بکار برده می شوند این حقیقت است که مخلوط طلا، نقره و مس با فلزات دیگر باعث کاهش واکنش پذیری این مخلوطها می شود، بطوری که می توان آنها را محلولهای ایده آل تصور کرد. “گرین ودوارن شاو” عقیده دارد که می توان آنها را ترکیبات بین فلزی غیر استوکیومتری با ساختارهائی معین در نظر گرفت …»
معمولاً وقتی مردم ناراحتی حساسیت زائی را نسبت به یک قطعه «طلای واقعی» احساس می کنند تقریباً همیشه پای یکی از فلزات همراه در میان است و معمولاً نیز انگشتنماترین پای ثابت در این نوع حساسیتها فلز نیکل است. به نظر می رسد بعضی از افراد حساسیت شگفت آوری را نسبت به این فلز از خود نشان میدهند. این رخداد اغلب بیدرنگ پس از سوراخ کردن گوش و آویزان کردن گوشوارهی آبکاری شده با طلا رخ می دهد. به دلیل اینکه اغلب از طلاکاری خیلی نازک روی لایه ای از نیکل استفاده می شود، جای تعجب نیست شخصی که از گوشوارهها استفاده می کند تحت تأثیر مقادیر معتنابهی از نیکل قرار گیرد. چون لایه طلا اغلب ترک می خورد یا خراش بر می دارد. چیزی که جالب است اینست که بدن تنها زمانی یاد میگیرد چگونه واکنش نشان دهد که پیشتر نیز تحت تأثیر این یونها قرار گرفته باشد. ساز و کار دقیق این حساسیتها کاملاً شناخته شده نیست.
منبع:www.asemooni.com

در سالهای اخیر تولید شمش طلا و نقره تقلبی رو به افزایش بوده است. در حقیقت طلای بدلی حتی توانسته به منطقه دایموند با اعتبار نیویورک هم نفوذ کند. کلاه شمش تقلبی به سر طلافروشان زبده هم گذاشته شده است.
در اینجا به هفت تست تشخیص طلای تقلبی و واقعی اشاره میکنیم: تست آهن ربا، تست یخ، تست پینگ، تست اسید، تست وزن و سونوگرافی و کولیس!
انواع شمش تقلبی
شمش و سکه روکش دار: سکه ها و شمش هایی که یک لایه بسیار نازک طلا و نقره روی فلز دیگری آبکاری شده است.
شمش توخالی: معمولاً لایه نازکتری از طلا دارد (برخی اوقات هم نقره) که داخل آن با تنگستن یا سرب پر شده و معمولاً 10 اونس تا 14 اونس است. کلاهبردارها با هدف کسب مبلغ هنگفتتر در تقلب شمشهای بزرگ ریسک میکنند.
از کجا بدانم طلایی که میخرم واقعیست؟
در اینجا به چند تست مفید اشاره شده که برای اطمینان از ناب بودن طلا و نقره کمک میکند.
تست آهنربا
نقره دیامگنتیک است (یعنی آهنربا آن را جذب نمیکند) و زمانی که به آهنربای قوی نزدیک شود در سطح شمش نقره مقاومت احساس میشود.
نکته: اگر هریک از محصولات طلا یا نقره شما به آهنربا جذب میشود، بدانید که یک جای کار میلنگد.
تست یخ
1. روی طلا یا نقره یک تکه یخ بگذارید.
2. نقره در میان تمام فلزات بیشترین رسانای انرژی گرمایی است. باید یخ بلافاصله شروع به ذوب شدن کند گویی آن را روی شیء داغی قرار دادهاید و سرعت ذوب آن نباید مشابه ذوب در دمای اتاق باشد.
تست پینگ
با یک تکه فلز دیگر به شمش ضربه کوچکی بزنید. باید صدای زنگ را بشنوید که 1 تا 2 ثانیه طول داشته باشد. اگر صدای عجیب دیگری شنیده شد، مشکلی وجود دارد.
تست اسید
احتیاط! اسید یک ماده خورنده است و به شمش آسیب میرساند.
1. یک بسته تست اسید خریداری کنید.
2. قطرهای اسید را به شمش بزنید. این باعث میشود رنگ محل تست تغییر کند.
3. اگر رنگ آن قرمز، قهوهای یا سبز بود، شمش واقعی است. اما هر رنگ دیگر نشان از تقلبی بودن شمش دارد.
سونوگرافی!
یک روش بدون تخریب که در تشخیص بارداری استفاده میشود برای چک کردن همنواختی شمش هم استفاده میشود.
مقیاس ضخامت فراصوتی این تست مشخص میکند چه مدت زمانی برای عبور صدا از ماده طول میکشد. صدا با سرعتهای مختلف از داخل فلزات متفاوت عبور میکند.
تست وزن
1. شمش را روی ترازوی دقیقی وزن کنید و عدد آن را یادداشت کنید.
2. داخل ظرفی آب بریزید و ظرف را روی ترازو قرار دهید سپس ترازو را به صفر برسانید. (در صورت امکان از آب مقطر استفاده کنید)
3. شمش را بطور کامل در آب فرو ببرید اما به ظرف و ترازو دست نزنید. حالا عدد را یادداشت کنید.
4. عدد اول را به عدد دوم تقسیم کنید. رقم به دست آمده برای نقره خالص باید 10.49 و برای طلای خالص 19.32 باشد.
تست کولیس
همه شمش ها ابعاد و تلرانس استحکام مشخصی دارند. بطور مثال عقاب نقره ای آمریکا همیشه یک تروی اونس وزن، 2.98 میلیمتر ضخامت و 40.6 میلیمتر قطر دارد که بر اساس این مشخصات به وضوح میتوان انواع تقلبی را جدا کرد.
در هنگام خرید
به گزارش اخبار بانک، در پایان، بهترین راه اطمینان از واقعی بودن فلز گرانبهایتان آن است که بدانید از چه کسی خرید میکنید. از کسانی که قیمتهای منحصر بفردی روی وبسایتهایی نظیر ای.بی پیشنهاد میکنند، دوری کنید.
منبع:www.shabnamnews.com
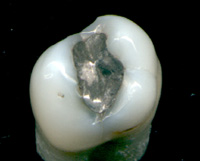
آمالگام دندانی مادهای غیر همرنگ (نقره ای یا سیاه) است که برای پر کردن دندان از آن استفاده میشود و تشکیل شده از 50% جیوه ، 34.5% نقره ، 9% قلع ، 6% مس و 0.5% روی است.
آمالگام به مدت بیش از صد سال است که در سراسر دنیا برای ترمیم دندان استفاده می شود. این ماده در سال 1812 توسط یک شیمیدان انگلیسی شناخته و در سال 1833 به دنیا معرفی شد. قبل از آمالگام، دندان پزشکان برای پر کردن دندان از موادی چون تراشههای سنگ و صمغ و چوب پنبه و تربانتین و سرب و طلا و … استفاده میکردند.
آمالگام یک ماده ترمیمی فوق العاده و انعطاف پذیر است و در دندانپزشکیها به چند دلیل استفاده میشود. ارزان است و نسبتا استفاده آسانی دارد و در طول جاگذاری در دندان، به راحتی شکل میپذیرد. برای مدت کوتاهی نرم میماند لذا میتواند حجمهای نامنظم دندان را پر کند و سپس سفت میشود. آمالگام نسبت به مواد ترمیم کننده دیگر مانند کامپوزیتها دارای طول عمر زیادی است. طبق مطالعهای در سال 1989 بیشتر آمالگامها 10 تا 12 سال دوام میآورند در حالی که کامپوزیتهای دندانی نصف این مدت دوام میآورند. به هر حال این اختلاف با کار کردن پیوسته روی خصوصیات فیزیکی کامپوزیتها، کاهش یافتهاست.
منبع: دپارتمان شیمی
ترینیتروتولوئن یا تیانتی (TNT) یا تروتیل یک مرکب هیدروکربن معطر بلوری و زرد رنگ است که در 354 درجه کلوین ذوب میشود. تیانتی ماده منفجره است که سرعت انفجار آن 7028 متر در ثانیه میباشد و در بسیاری از ترکیبات انفجاری بکار میرود. تیانتی بهوسیله نیتراسیون تولوئن C6H5CH3 تهیه میشود و فرمول شیمیایی آن (CH3(NO2)C6H2) و نام آیوپاک آن 2,4,6 Trinitromethylbenzene است.
ویژگیهای ظاهری
تری نیترو تولوئن کریستالهای سوزنی شکل زرد کمرنگی است که میتواند در یک فضای بی هوا (خلاء) تقطیر شود. تیانتی در آب بسختی قابل حل است؛ بیشتر در اتر و استون، بنزین و پیریدین حل میشود. به دلیل پائین بودن نقطه ذوب تیانتی در 35/80 درجه سانتیگراد میتوان آنرا در آب گرمکن ذوب کرد و به آن شکل داد. تیانتی سمی است و تماس آن با پوست میتواند تولید آلرژی و واکنش انفعالی شدید تولید کند، این واکنش شدید پوست را به رنگ زرد متمایل به نارنجی در میآورد. • قابلیت ذوب در آب: 130 میلی گرم / لیتر در 20 درجه سانتیگراد • در بخار تحت فشار: 20 درجه سانتیگراد 5/1 – 6 mbar • سرعت انفجار: 6700 -7000 میلی / ثانیه 6900 میلی/ثانیه (چگالی: 1/6 گرم/سانتیمترمکعب • تست با حافظ سرب: 300 میلی لیتر / 10 گرم • حساسیت ضربه زنی: 15 Nm (1/5 کیلو در متر)
منبع: دپارتمان شیمی
گروه های تحقیقاتی HRL، Caltech و UC Irvine با همکاری هم ، سبکترین ماده جدید جهان را ساختند، این ماده حدود صد برابر سبکتر از استریوفوم بوده، حتی از ماده فوق سبک اروژل (aerogel) نیز سبکتر است.
ساختار این ماده به صورت یک ریز شبکه است. 0?01 درصد این ماده جامد شامل لوله های توخالی با ضخامت فقط 100 نانومتر است. چگالی این ماده 0?9 میلیگرم بر سانتیمتر مکعب حتی سبکتر از کم وزن ترین ماده جهان یعنی اروژل (با چگالی 1/1 میلی گرم بر سانتی متر مکعب) می باشد. این ماده به طور فوق العاده ای محکم بوده، ضربه پذیر است، به طوریکه تا 50 درصد فشرده میشود و مجدداً به شکل اولیه خود باز می شود. این قابلیت برای ماده ای که اساساً فلزی است بسیار غیرمعمول به نظر میرسد. این گروه بیشتر به جنبه ساختار معماری این ماده فکر کرده اند تا فوق سبک بودن آن یعنی به طور مثال به پل گلدن گیت و برج ایفل از این زاویه نگاه کرده اند که چگونه می توان با حفظ مقاومت ساختار آن ها، از وزنشان کاست.
این پروزه همچین برای دارپا مؤثر است، زیرا آن ها می توانند از این ماده برای انواع محصولات خود از جمله الکترودهای باتری جهت کاهش انرژی و نصب آن استفاده کنند، که این کار در گذشته توسط ماده سبک وزن اروژل انجام میشد.
دارپا: DARPA
گلدن گیت: Golden gate
منبع: دپارتمان شیمی
لوئیس بروس استاد رشته شیمی دانشگاه کلمبیا، در دهه 1980 موفق به کشف نقاط کوانتومی شد؛ کشفی که حاصل آن جوایز بیناللملی متعددی بود. مقالههای بروس درباره کشف نقاط کوانتومی بیش از 3500 ارجاع داشته است. در حال حاضر محققان مختلفی در سراسر جهان روی این خوشههای اتمی تحقیق میکنند.
محققان عربستانی موفق به ارائه روشی برای تولید انبوه نقاط کوانتومی شدند. این روش بسیار ارزان بوده و کیفیت محصول نهایی آن بسیار بالا است. این روش میتواند مسیر تجاریسازی نقاط کوانتومی را هموار کند. نقاط کوانتومی مواد بسیار جالبی برای استفاده در اپتوالکترونیک، حسگری و سلولهای فتوولتائیک هستند. دلیل این امر، قیمت پایین آنها و باند گپ قابل کنترل در این مواد است. در واقع با تغییر ابعاد نقاط کوانتومی میتوان مقدار جذب نوری این نانوبلورها را کنترل کرد. این ترکیبات برای تولید ادوات قابل چاپ به روش رول به رول بسیار ایدهآل هستند. یکی از دلایلی که موجب شده تا نقاط کوانتومی در مرحله تجاریسازی موفق نباشند، روش تولید آنها است. هنوز از روشهای سنتز دستی (در فلاسکهای واکنش کلاسیک) برای تولید این ترکیبات استفاده میشود. از آنجایی که کنترل ابعاد این ساختارها بسیار مهم است، باید پارامترهای سنتز به دقت کنترل شوند تا بتوان به محصولی با ابعاد مشخص و از قبل تعیین شده رسید. از سوی دیگر کنترل دقیق این پارامترها (دما و غلظت مواد اولیه) در واکنشهایی در مقیاس کوچک امکانپذیر است، بنابراین تولید انبوه این ترکیبات کار بسیار دشواری است به طوری که تولید انبوه نقاط کوانتومی با کیفیت بالا بسیار پرهزینه خواهد بود. همانند تشکیل قطره باران، تولید نقاط کوانتومی با هستهزایی و رشد انجام میشود، این دو فرآیند به شدت وابسته به دما و غلظت هستند. برای تولید نقاط کوانتومی با ابعاد یکنواخت باید بتوان به سرعت دمای واکنش را در مرحله هستهزایی به دمای رشد کاهش داد. بنابراین، کیفیت محصول به این بستگی دارد که چقدر تمام بخشهای راکتور بتواند شرایط دمایی و شیمیایی یکسانی داشته باشد. تاکنون چنین شرایطی برای تولید نقاط کوانتومی ایجاد نشدهاست. محققان دانشگاه ملک عبدالله کانالهایی با قطر کمتر از یک میلیمتر ساختهاند که میتوان سیال حاوی مواد اولیه را وارد آن کرد. با توجه به کوچک بودن ابعاد کانال کنترل دما به راحتی قابل انجام است از سوی دیگر بهصورت خودکار غلظت مواد اولیه در حین پمپ کردن سیال به داخل کانال کنترل میشود. پژوهشگران مرحله هستهزایی و رشد را در دو بخش جداگانه انجام دادند به طوری که دو کانال جداگانه برای این کار در نظر گرفته شدهاست. نتایج این پروژه نشان داد که میتوان نقاط کوانتومی با کیفیتی بالا را با هزینه کم و به صورت انبوه با این روش تولید کرد.
منبع: دپارتمان شیمی