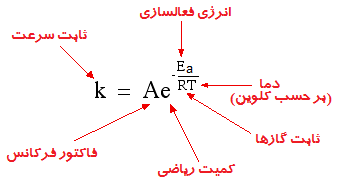
انتقال الکترون درون پیلهای خورشیدی توسط محققان دانشگاه تورنتو با استفاده از یک وسیله تحت عنوان دودکش کوانتومی افزایش یافت. مزیت اصلی این کار آن است که موجب میشود تا نیروی بیشتری بهدرون دستگاه منتقل شده و بهره پیل خورشیدی را افزایش دهد.
این تیم تحقیقاتی که به رهبری ادوارد سرجنت میباشد روی پیلهای خورشیدی ساخته شده از نقاط کوانتومی کلوئیدی (CQDs) کار میکنند. این مواد بسیار جالب توجه هستند زیرا خواص فتوالکتریک آنها با تغییر اندازه دانهها تغییر میکند. این پدیده که به “اثر اندازه” شهرت دارد برای کنترل پاسخ نقاط کوانتومی به نور مورد استفاده قرار میگیرد بهطوری که با تغییر باندگپ مواد این پاسخها تغییر میکنند. از این مواد برای ساخت پیلهای خورشیدی دو بخشی استفاده میشود که در آنها پرتو مادون قرمز و مرئی خورشید در دو بخش جداگانه پیل جذب شده و تبدیل به الکتریسیته میشود. تیم تحقیقاتی دانشگاه تورنتو یک گام به جلوتر گذاشته و با استفاده از درجه آزادیهای مختلف در محدودیت کوانتومی، انتقال الکترون را در پیلهای خورشیدی CQD افزایش دادهاند. از آنجایی که یکی از مشکلات اصلی این پیلها، کم بودن سرعت انتقال الکترون است بنابراین این پروژه میتواند بزرگترین چالش موجود در این حوزه را حل کند. عملکرد این سیستم چگونه است؟ از آنجایی که باندگپ CQD ها بهراحتی با کاهش یا افزایش قطر آنها قابل تنظیم است و همچنین میتوان با این کار هدایت این ساختارهای را نیز تنظیم کرد، بنابراین محققان میتوانند لایههای CQD را روی هم قرار دهند بهنحوی که با بالاتر رفتن لایهها، باندگپ آنها افزایش یابد. با این کار میتوان پروفایل انرژی را در لایهها بهنحوی ایجاد کرد که الکترونها از ساختارهای دارای بزرگترین باند گپ بهسوی ساختارهایی با کمترین باند گپ مهاجرت کنند. به این سیستم، اثر دودکش گفته میشود.
مهمترین مزیت این روش آن است که هنگام انتقال نیرو از پیل خورشیدی به دستگاه خارجی، برانگیختگی جریان افزایش مییابد. فاکتور انباشت ( فاکتوری مهم در پیلهای خورشیدی که نسبت ماکزیمم توان قابل استحصال بر مقداری تئوری است) در این سیستم 54 درصد است که در مقایسه با مقدار 37 درصد که مربوط به دستگاههای قبلی فاقد دودکش کوانتومی، رقم قابل ملاحظهای است. بهره این سیستم نیز 2?7 درصد بیشتر دستگاههای فاقد دودکش کوانتومی است. این تیم تحقیقاتی درصدد است تا به بررسی چگونگی مهندسی پروفایل انرژی در ادوات CQD بپردازد. نتایج این تحقیق در نشریه Nano Letters به چاپ رسیده است.
منبع: دپارتمان شیمی